Wanneer je een bak water van 20° C buiten in ijskoude lucht zet zal dit sneller bevriezen dan een bak van 30° C. Dat is voor de hand liggend. Echter, er zijn omstandigheden waarbij de bak water van 30° C eerder bevriest dan die van 20° C. Dit is volstrekt tegen-intuïtief. Toch blijkt uit waarnemingen dat dit soms op kan treden. Het wordt wel het Mpemba-effect genoemd, naar de Tanzaniaanse scholier Erasto Mpemba, die dit verschijnsel in 1963 waarnam bij het bevriezen van roomijs.
Aristoteles (384 v.Chr.-322 v.Chr.) kende dit verschijnsel al. Hij veronderstelde dat elke eigenschap in de natuur een tegenovergesteld effect sorteerde. Het menselijk lichaam zou om die reden in de winter warmer zijn dan in de zomer. Om kou tegen te gaan wordt het lichaam vanzelf warmer. Zo zou een bak heet water eerder bevriezen, juist omdat het intrinsiek meer kou oproept. Deze eigenschap van materie noemde hij antiperistasis. Later is deze zienswijze van Aristoteles door de wetenschap weerlegd.
Het Mpemba-effect blijkt op te treden bij snelle afkoeling van water in bijvoorbeeld een vrieskist. Het gebeurt ook bijna alleen bij water, nauwelijks bij andere vloeistoffen (een uitzondering is glycerol). Dat komt omdat water een aantal bijzondere eigenschappen heeft. Zo is de dichtheid van water het grootst bij 4° C. Water zet als enige vloeistof uit als het bevriest. Alle andere vloeistoffen krimpen juist bij stolling (= bevriezing).
Dit komt door de zogenaamde waterstofbruggen. Zoals bekend bestaat een watermolecuul H2O uit twee waterstofatomen (H) en één zuurstofatoom (O). Een waterstofatoom staat gemakkelijk een (negatief geladen) elektron af, terwijl een zuurstofatoom juist geneigd is twee elektronen op te nemen. Dit zorgt ervoor dat een molecuul H2O elektrisch gezien min of meer uit evenwicht is. Aan de ene kant (die van het zuurstofatoom) is het watermolecuul meer negatief geladen dan aan de andere kant (die van de waterstofatomen). Dit maakt het watermolecuul tot een dipool. Dit weer zorgt ervoor dat watermoleculen waterstofbruggen vormen, een sterke aantrekking tussen de negatieve kant van het ene watermolecuul en de positieve kant van een naburig watermolecuul. De onderlinge krachten die hiermee gepaard zijn, zijn zeer sterk. Met onder andere als gevolg dat water een veel hoger kookpunt (100° C) heeft dan je op grond van de atoomsamenstelling zou verwachten.
Waterstofbruggen, waarbij H-atomen zich richten naar O-atomen (en andersom). 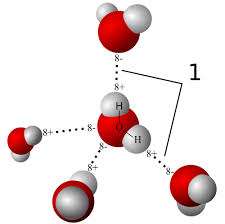
Al deze eigenschappen bij elkaar verklaren echter nauwelijks dit vreemde Mpemba-effect. De wetenschap is er ook nog niet uit hoe dit precies ontstaat. Wel weet men dat:
- Als water warmer is, zijn er minder gassen in opgelost. Minder opgeloste gassen betekent een snellere afkoeling.
- Water in de diepvries raakt snel onderkoeld. Er is minder uitwisseling mogelijk met de omgeving, omdat de warmte niet direct afgevoerd kan worden. In de buitenlucht wel. Er is dus een verschil tussen koud water dat vanuit relatief hoge temperatuur onderkoeld is geraakt en gewoon natuurlijk koud water. Onderkoeld water blijkt sneller te bevriezen.
- Bij een bak met heet water verdampt er tijdens het afkoelen meer water dan bij een bak met koud water. Het volume zal daardoor flink afnemen. Minder volume betekent eerdere bevriezing.
- Door de aanwezigheid van waterstofbruggen zou heet water sneller energie vrijgeven dan koud water. Dit gaat zo snel en massaal dat de bevriezing van een bak met koud water wordt ´ingehaald`.
Een echt sluitende theorie voor het verklaren van het Mpemba-effect is er echter niet. Dat maakt het tot een interessant probleem. De oplossing zal waarschijnlijk een combinatie van bovengenoemde factoren zijn. Daaruit zal in de toekomst toch een eenduidige intrinsieke eigenschap van water tevoorschijn moeten kunnen treden. Voor de onderzoekers onder ons nog flink wat werk aan de winkel.
Het Mpemba-effect
Plaats reactie

